针对“手性金属卡宾催化的精准调控”这一科学难题,施世良团队长期致力于发展新型优势手性氮杂环卡宾(NHC)配体及其在重要挑战性不对称反应中的应用。他们发展了ANIPE和SIPE系列新型大位阻灵活C2对称手性NHC配体,并应用于多类挑战性的金属催化不对称偶联反应,包括交叉偶联(不对称Suzuki偶联: J. Am. Chem. Soc. 2019, 141, 14938; 低温不对称碳氮偶联: Angew. Chem., Int. Ed. 2021, 60, 16077; 不对称Heck类偶联: Nat. Catal. 2022, 5, 934),转氢偶联(不对称氢芳基化:J. Am. Chem. Soc. 2019, 141, 5628; Angew. Chem. Int. Ed. 2019, 131, 13567; J. Am. Chem. Soc. 2022, 144, 13643; 不对称氢硼化: Angew. Chem. Int. Ed. 2018, 57, 1376),和羰基偶联(酮芳基化: Angew. Chem. Int. Ed. 2021, 60, 5262; 醛芳基/烯基化: CCS Chem. 2022, 4, 1169; 醇芳基化: J. Am. Chem. Soc. 2021, 143, 11963; 醇-炔偶联: ACS Catal. 2019, 9, 1; 醛-炔-烯酮偶联: J. Am. Chem. Soc. 2022, 144, 130)。
羰基加成反应是有机合成中最常用的碳碳成键反应之一,但是由于缺乏高效的消旋化策略和催化体系,非活化酮的动态动力学不对称加成反应一直未有报道。近期,施世良团队发现了镍卡宾络合物催化酮快速消旋化的新过程。根据对照实验和团队前期的η2活化羰基偶联工作基础,他们推测该过程经过酮与卡宾-镍(0)的η2配位并氧化环合生成镍杂三元环中间体,继而发生b-H消除、再插入以及还原消除实现手性酮的快速消旋化。结合此发现,利用自主研发的手性卡宾ANIPE-镍催化剂,他们实现了非活化酮的动态动力学不对称芳基化和烯基化反应。反应以稳定易得的芳基或烯基硼酸酯为偶联试剂,具有良好的官能团和杂环兼容性。反应底物范围广泛,适用于a-芳基、胺基、或氧取代的酮,甚至全烷基取代酮。手性ANIPE-镍催化剂的使用,实现了挑战性的动态动力学转化过程的速率匹配、手性识别和非对映、对映选择性控制。催化剂成功调控了两个连续手性中心高效构筑。该工作为通过其他途径难于制备的复杂手性叔醇的高效高立体选择性合成提供了通用的新方法。快速消旋化新途径和镍卡宾催化策略为发展其他挑战性动态动力学不对称羰基转化提供了新思路。
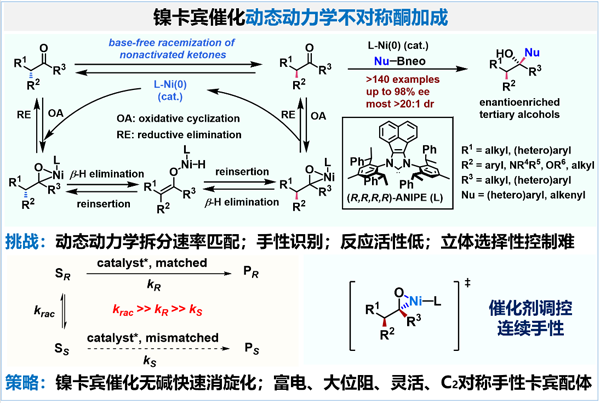
图1. 镍卡宾催化酮的动态动力学不对称芳基化和烯基化反应
以上工作得到科技部国家重点研发计划、中科院、国家自然科学基金委、上海市科委、上海有机所以及金属有机化学国家重点实验室的大力资助。
课题组招收博士生和博士后,有意者请联系施老师(email: shiliangshi@sioc.ac.cn)。
